-
Sabias que el boro es un protector de la próstata
-
Bajar el colesterol de forma natural

La dislipidemia se considera un factor de riesgo independiente de las enfermedades cardiovasculares , que a nivel mundial conllevan una alta mortalidad, discapacidad y elevados gastos médicos . Además, diversos estudios han revelado que el colesterol no HDL elevado es la principal causa de cardiopatía isquémica y accidente cerebrovascular. Dado que la prevención primaria desempeña un papel crucial en la disminución de la incidencia de las ECV , los avances en la modificación de la dislipidemia son de gran ayuda para reducir la morbilidad y la mortalidad asociadas a las ECV.
Actualmente, las estatinas, fármacos de primera línea para reducir los lípidos, presentan reacciones adversas como mialgia, daño hepático y diabetes, especialmente cuando se utilizan en dosis elevadas . Efectos secundarios similares, como miopatía, elevación de las enzimas hepáticas y colelitiasis, también se observan en el tratamiento de la dislipidemia con fibrato. Si bien se han desarrollado inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), su elevado costo y la falta de evidencia sobre su seguridad limitan su aplicación clínica . Además, se ha observado una respuesta terapéutica insatisfactoria y resistencia a los fármacos en algunos pacientes. Evidentemente, el desarrollo de tratamientos adicionales y alternativos sigue siendo fundamental para la terapia de la dislipidemia. (PMC9522446)
Las plantas medicinales, pilar fundamental de muchos sistemas de curación tradicionales en todo el mundo, ofrecen una vasta reserva de compuestos bioactivos que podrían ser clave para abordar la dislipidemia de forma natural e integral. Además de las plantas medicinales tenemos; vitaminas, minerales y otros`productos naturales que ayudan a regular el colesterol de forma fisiologica.
ALIMENTOS
En un metaanálisis amplio, con 14 ECA con 1107 participantes; la linaza, en dosis de (2-40 g), en pacientes dislipidémicos, baja colesterol total (CT), las lipoproteínas de baja densidad (LDL-C) y los triglicéridos (TGL), en comparación con el grupo de control ( doi.org/10.1016/j.cpcardiol.2021.100931) . En 40 pacientes con enfermedad arterial periférica, 30 gramos de semilla de lino molido al día baja el colesterol total un 11% y el LDL-C un 15 % en un tratamiento de 6 a 12 meses (DOI: 10.3945/jn.114.204594 ). En un estudio de 31 ECA con 1698 participantes la linaza entera, tuvo un efecto fue pronunciado con dosis ≤ 30 g/día (CT: DMP – 13,61 mg/dl; LDL-C: DMP – 10,52 mg/dl; TG: DMP – 23,52 mg/dl), en comparación con dosis > 30 g/día. (PMCID: PMC8504108).
En 21 pacientes hiperlipidémicos, 40 g de sésamo tostado, durante 6 semanas, reduce colesterol total y colesterol LDL en un 6,4 % y un 9,5 % respectivamente (doi.org/10.1016/j.nutres.2005.05.007). En 38 pacientes hiperlipidémicos, durante 60 días, 40 gr de semilla de desamo reduce el CT: de 241 a 221 mg/dl, el LDL-C de 159 a 144 mg/dl y TGL de 168 a 153 mg/dl. sin cambios en HDL-C (DOI: 10.3109/09637486.2011.652077). En un metaanálisis amplio; se incluyeron 16 ensayos con 908 participantes; la ingesta de sésamo disminuyó significativamente los niveles de colesterol total, triglicéridos, presión arterial sistólica, presión arterial diastólica, peso corporal, índice de masa corporal, circunferencia de cadera y circunferencia de cintura ( DOI:10.1080/10408398.2021.1888689).
El ajo es eficaz para reducir el colesterol sérico total en 17 ± 6 mg/dL y el colesterol LDL en 9 ± 6 mg/dL en personas con niveles elevados de colesterol total (>200 mg/dL), siempre que se consuma durante más de dos meses. Una reducción del 8 % en el colesterol sérico total es clínicamente relevante y se asocia con una reducción del 38 % en el riesgo de eventos coronarios a los 50 años (DOI: 10.1111/nure.12012 ).
En 60 pacientes hiperlipémicos, 10 ml al día de aloe, redujo el colesterol total en un 15,4%, los triglicéridos en un 31,9% y del colesterol LDL en un 18,2%. ( PMCID: PMC9732414 ).
El tratamiento con Amla ( 500 mg) produjo una reducción significativa del colesterol total (CT) (p < 0,0001), el colesterol LDL (p < 0,0001), los triglicéridos (TG) y el colesterol VLDL (p < 0,0002), así como un aumento significativo del colesterol HDL (p < 0,0002). De manera similar, el tratamiento con simvastatina ( 20 mg/día ) produjo una reducción significativa del CT (p < 0,0001), el colesterol LDL (p < 0,0009), los TG y el colesterol VLDL (p < 0,017), y un aumento significativo del colesterol HDL (p < 0,0001). Ambos tratamientos redujeron significativamente la presión arterial; sin embargo, este efecto beneficioso fue más marcado en los pacientes que recibieron Amla. (PMID: 22529483 ). Por tanto el amla es igual a la simvastatina para bajar el colesterol.
La hoja de alcachofa; en un metaanálisis de datos de 9 ensayos con 702 participantes sugirió una disminución significativa en las concentraciones plasmáticas de colesterol total (DMP: -17,6 mg/dL,), colesterol LDL (DMP: -14,9 mg/dL) y triglicéridos (DMP: -9,2 mg/dL,). ( DOI: 10.1080/10408398.2017.1332572).
En este metaanálisis se incluyeron un total de 50 ensayos. Se observó una reducción significativa del colesterol total (DMP: -16,80), los triglicéridos (DMP: -15,73), el colesterol LDL (DMP: -18,45) y el colesterol VLDL (DMP: -3,7) tras la suplementación con comino negro (Nigela. sativa). ( DOI: 10.1002/ptr.6708).
La ingesta de 1 g/día de espirulina administrada durante 12 semanas en población abierta (n=52, edad: 37-61 años) con dislipidemia e hipertensión (CT >200 mg/dL, TGL >150 mg/dL, C-HDL <40 mg/dL, presión sanguínea > 140/90 mmHg). Observan una disminución en los TGL (-16.1%), C-LDL (-10.1%) y CT (-10.8%) DOI: 10.1002/jsfa.6261. FIBRA DIETETICA
El tratamiento con 5,1 g de psilio dos veces al día produce reducciones netas significativas en las concentraciones séricas de colesterol total (- 4,7% ) y LDL-C (- 6,7 %) en hombres y mujeres con hipercolesterolemia primaria (DOI: 10.1093/ajcn/71.6.1433). En un metaanálisis que incluía 384 personas: El consumo de 10,2 g de psilio/día redujo el colesterol total sérico en un 4% Y , el colesterol LDL en un 7% y la relación de apolipoproteína B (apoB) a apoAI en un 6% ( DOI: 10.1093/ajcn/71.2.472).
Doce estudios ( n = 370), 8 en adultos y 4 en niños, concluyen que la ingesta de aproximadamente 3 g de glucomanano de konjac (KJM) día para reducciones del colesterol LDL y del colesterol no HDL del 10 % y el 7 %, respectivamente (DOI: 10.3945/ajcn.116.142158 ).
En comparación con los grupos de control, la suplementación con goma guar disminuyó el colesterol total (CT) en -20,41 mg/dL, y el colesterol de lipoproteínas de baja densidad (LDL-C) en -17,37 mg/dL, pero no modificó los triglicéridos (TG) (DMP: -6,53 mg/dL) ni el colesterol de lipoproteínas de alta densidad (HDL-C) (DMP: -0,62 mg/dL,) (DOI: 10.1016/j.numecd.2021.08.040 ). Un análisis combinado de diecinueve ensayos controlados aleatorizados (ECA) reveló que la suplementación con goma guar produjo reducciones significativas en el colesterol total (DMP: -19,34 mg/dl) y el colesterol LDL (DMP: -16,19 mg/dl, ). ( DOI: 10.1017/S0007114522002136 ).
25 gr de salvado de avena al día, salvado de avena redujo significativamente las concentraciones de colesterol total y colesterol LDL en suero en un 5,4 % y un 8,5 %, respectivamente ( DOI: 10.1093/ajcn/52.3.495).
En un metaanálisis de 11 ECA con 1011 participantes, la suplementación con quitosano se asoció con una disminución del colesterol total (CT) (−1,39 mmol/L; ), del colesterol LDL (−0,83 mmol/L;) y de los triglicéridos (TG) (−1,06 mmol/L;). No se observaron cambios significativos en el colesterol HDL ( doi.org/10.3390/medicina54060109. Dosis :0,3 y 3 g al día.
En un ensayo aleatorizado cruzado con 90 participantes con dislipidemia, se observó una disminución del colesterol total (CT) (-5,41 ± 7,27 %) y del colesterol LDL (-8,05 ± 9,31 %) en los pacientes tratados con pectinas de cítricos con alto grado de esterificación. De manera similar, se observó una disminución del CT (-6,54 ± 6,49 %) y del colesterol LDL (-9,26 ± 9,71 %) con pectinas de manzanas con alto grado de esterificación. (doi.org/10.1038/ejcn.2011.208 )
SUPLEMENTOS
En una revisión que incluye 12 estudios con un total de 548 participantes. El acido alfa lipoico (ALA) produjo una reducción significativa en el colesterol total (DMP: -10,78 mg/dl,), el colesterol LDL (DMP: -10,88 mg/dl, ) y los triglicéridos (DMP: -31,02 mg/dl,) (DOI: 10.1024/0300-9831/a000732 ). dependiendo de la dosis entre 300 a 1200 mg/dia.
Se incluyeron 18 estudios que utilizaron dosis de berberina de 900 a 1500 mg/día, en promedio, la berberina puede reducir ligeramente el colesterol LDL en 0,5 mmol/L (18 mg/dL), el colesterol total (-0,48 mmol/L, (19 mg/dl), y los triglicéridos en 0,3 mmol/L (30 mg/dL). (DOI: 10.1007/s40265-023-01841-4 ). Un metaanálisis de 19 ensayos controlados aleatorizados y estudios transversales con 1372 participantes reveló que la berberina redujo el colesterol total (CT) (1,17 mmol/L; ), el colesterol LDL (1,06 mmol/L; ) y los triglicéridos (TG) (0,60 mmol/L), e incrementó el colesterol HDL (0,24 mmol/L ) [ doi.org/10.1089/jmf.2019.0088 ].
Un metaanálisis se incluyeron ocho ensayos (267 participantes en el grupo de intervención y 259 en el grupo placebo). Los resultados mostraron que la administración de CoQ10 a pacientes con enfermedad arterial coronaria disminuyó significativamente el colesterol total (DME -1,07; y aumentó los niveles de colesterol HDL (DME 1,30; ) (PMID: 30296936 ). Un metaanálisis que incluye 7 ECA: CoQ10 redujo significativamente el colesterol total (SMD=-0,58;el colesterol LDL (SMD=-0,47; niveles de creatinina (SMD=-1,65) pacientes diagnosticados con de insuficiencia renal crónica .(DOI: 10.2174/1381612824666181112112857). 101 personas dislipidémicos que no tomaban ningún fármaco hipoglucemiante o hipolipemiante recibieron 120 mg de CoQ10 o placebo diariamente durante 24 semanas. El tratamiento con coenzima Q10 durante 24 semanas redujo los triglicéridos al 12,6%, el colesterol LDL al 7,6% y aumentó la ApoA-I al 7,7%. a la vez que disminuyó el índice de resistencia a la insulina (DOI:10.1016/j.jacl.2017.12.006). En definitiva, coenzima Q10 tiene un efecto beneficioso en la reducción de los niveles de colesterol y en la disminución del riesgo de enfermedades cardiovasculares a una dosis de 120 mg diarios (PMID: 38445038)
La dosis oral habitual oscila entre 500 mg y 3 g, pudiendo alcanzar hasta 6 g al día: En un metaanálisis de 55 ECA con 3058 participantes, aquellos en el grupo de suplementación con L-carnitina mostraron una reducción en el colesterol total (CT) (−0,22 mmol/L), el colesterol LDL (LDL-C) (−0,14 mmol/L; ) y los triglicéridos (TG) (−0,11 mmol/L;), así como un aumento en el colesterol HDL (HDL-C) (0,04 mmol/L). Los autores hallaron que dosis más altas de L-carnitina (≥2 g) produjeron una mayor reducción en el CT y el LDL-C (DOI: 10.1016/j.numecd.2019.07.012). En un metaanálisis de 67 estudios: :L-carnitina produjo una disminución significativa en las concentraciones de triglicéridos (DMP: -10,35;), colesterol total (DMP: -9,47; IC del y colesterol LDL (LDL-C) (DMP ), y un aumento significativo en los niveles de colesterol HDL (HDL-C) (DMP: 1,39; ) ( DOI: 10.2174/1381612825666190830154336).
El aceite de semilla de espino amarillo, aproximadamente 0,75 Ml: En un metaanálisis de 13 ECA con 1167 participantes, la suplementación con espino amarillo disminuyó el CT (−0,35 mmol/L; ), los TG (−0,72 mmol/L; ) y el LDL-C (−0,40 mmol/L; y aumentó el HDL-C (0,37 mmol/L; IC del ) [ DOI: 10.1002/ptr.7596). En pacientes con síndrome metabólico el espino amarillo baja el CT, Los TG, EL LDL-C y aumento el HDL-C ( DOI: 10.1002/ptr.7596).
En un metaanálisis de 46 ECA con 4991 participantes con DM2, aquellos en el grupo de suplementación con aceite de pescado mostraron una disminución del colesterol total (CT) (−0,22 mmol/L; IC del 95 %, −0,32 a −0,11) y de los triglicéridos (TG) (−0,36 mmol/L; IC del 95 %, −0,48 a −0,25), así como un aumento del colesterol HDL (HDL-C) (0,05 mmol/L; IC del 95 %, 0,02 a 0,08). No se observaron cambios significativos en el colesterol LDL (doi.org/10.3390/jcm12103414).
Un metaanálisis de 33 ECA con 2704 participantes con síndrome metabólico investigó los efectos individuales de la suplementación con DHA y EPA frente al grupo de control. Quienes recibieron suplementación con EPA experimentaron una disminución en el colesterol total (−0,24 mmol/L; ) y en el colesterol LDL (−0,13 mmol/L; ). No se observaron cambios significativos en el colesterol HDL con la suplementación con EPA. En el grupo de suplementación con DHA, hubo una disminución de TG (−0,29 mmol/L; ) y un aumento de TC (0,14 mmol/L; ), LDL-C (0,26 mmol/L; ) y HDL-C (0,07 mmol/L; ) ( doi.org/10.1016/j.clnu.2021.05.025 ).
En su análisis se incluyeron un total de 17 ECA y 968 participantes con síndrome metabólico y factores de riesgo similares. En el grupo tratado con resveratrol, se observó una reducción significativa del colesterol total (CT) (−0,27 mmol/L; ), los triglicéridos (TG) (−0,10 mmol/L; ) y el colesterol LDL (LDL-C) (−0,147 mmol/L; ), pero no del colesterol HDL (HDL-C). También se observó una respuesta dosis-dependiente, con una mayor reducción del LDL-C en quienes tomaron resveratrol durante 12 semanas o más y en quienes padecían diabetes [ PMCID: PMC9506025 ).
Cincuenta y dos personas con hiperlipidemia leve se dividieron en dos grupos que recibieron 200 mg/día de extracto de semilla de uva roja (ESUR) o placebo durante 8 semanas. Tras un periodo de lavado de 8 semanas, los grupos intercambiaron los tratamientos durante otras 8 semanas. Se midieron los perfiles lipídicos y las LDL-ox al inicio y al final de cada fase. El consumo de RGSE redujo el colesterol total (-10,68 ± 26,76 mg/dL, p = 0,015), el colesterol LDL (-9,66 ± 23,92 mg/dL, p = 0,014) y el LDL oxidado (-5,47 ± 12,12 mg/dL, p = 0,008). Si bien el RGSE disminuyó los triglicéridos y el colesterol VLDL, y aumentó el colesterol HDL, estos cambios no fueron estadísticamente significativos (DOI:10.1089/jmf.2012.2408)
VITAMINAS
Un metaanálisis un total de 41 ECA con 3434 participantes (n = 1699 en el grupo de suplementación con vitamina D y n = 1735 en el grupo placebo, durante una media de 6 meses. Las diferencias de medias estandarizadas (DME) y los intervalos de confianza (IC) del 95 % para comparar el cambio desde el inicio hasta el seguimiento entre el grupo de suplementación con vitamina D y el grupo placebo (control) fueron los siguientes: colesterol total = -0,17 ; colesterol LDL = -0,12 ; triglicéridos = -0,12 . y colesterol HDL = -0,19. Las mejoras en el colesterol total y los triglicéridos fueron más pronunciadas en los participantes con deficiencia basal de vitamina D.( DOI:10.1093/nutrit/nuz037 ). La vitamina D, tiene un efecto beneficioso en la reducción de los niveles séricos de colesterol total, colesterol LDL y triglicéridos a una dosis de 1000 UI a 1500 UI diarias.
En un ensayo clínico aleatorizado triple ciego con 30 participantes, aquellos en el grupo de pantetina (forma dimérica de la vitamina B5) mostraron una disminución en el colesterol total (−6 %), el colesterol LDL (−11 %) y la apoB (−8 %). Sin embargo, no se observaron cambios significativos en el colesterol HDL, los triglicéridos ni la Lp(a) (PMID: 3516477).
La niacina (1 g/día – 3 g/día) es beneficiosa para aumentar el colesterol HDL y reducir los niveles de colesterol LDL, triglicéridos y colesterol total; sin embargo, deben tenerse en cuenta los posibles efectos secundarios (enrojecimiento facial, daño hepático) (doi.org/10.3390/nu10010041 y DOI: 10.1139/cjpp-2014-0478 )
PROBIOTICOS
6 estudios con 4 cepas diferentes de L. reuteri y 512 participantes. Los resultados mostraron que el consumo de L. reuteri redujo significativamente el colesterol total (CT) en 0,26 mmol/L en comparación con el grupo de control. el CT disminuyó significativamente cuando la suplementación con L. reuteri fue superior a 5 × 10⁹ unidades formadoras de colonias o la duración de la intervención fue inferior a 12 semanas. ( DOI: 10.1016/j.nutres.2023.06.004).
En un metaánalisis que incluye nueve ECA con 598 participantes: Lactobacillus redujo significativamente el colesterol unido a lipoproteínas de baja densidad (LDL) (DM -5,27 mg/dl) el colesterol total (DM -4,84 mg/dl* durante 12 semanas, en ≥1 × 10⁻¹ unidades formadoras de colonias/día ( DOI: 10.1016/j.clnu.2022.06.030).
Fórmula láctea con probióticos (FLP) (Lactobacillus acidophilus (La5), Lactobacillus casei (TMC) y Bifidobacterium lactis (Bb12)) sobre el perfil lipídico y la función intestinal en voluntarios sanos con hipercolesterolemia leve. 40 sujetos, 10 semanas. la ingesta de PMF redujo sustancialmente los niveles de colesterol total (CT; 8,1 %) y colesterol LDL (LDL-c; 10,4 %), demostrando así su eficacia cardioprotectora. Además mejoró significativamente el peso fecal, la motilidad fecal (disminuyendo el tiempo de tránsito gastrointestinal) al mejorar la microbiota intestinal (aumentando especies bacterianas beneficiosas como Lactobacillus y Bifidobacterium spp DOI: 10.1007/s12602-020-09728-6).
Evaluar el efecto de las cepas de Lactobacillus plantarum CECT7527, CECT7528 y CECT7529 (LP) sobre los lípidos séricos, 86 participantes adultos sanos con colesterol LDL elevado no tratado (≥ 160 mg/dl). Los participantes fueron asignados aleatoriamente a placebo o a LP (1,2 × 10⁹ UFC /día) durante 12 semanas, redujeron moderadamente el LDL-C ( -6,6 mg/dl) y el CT ( 11 mg/dl). en comparación con el placebo (PMCID: PMC12055864).
En conjunto, la evidencia preliminar actual respalda la eficacia de los probióticos/simbióticos para mejorar la dislipidemia y diversos parámetros lipídicos, especialmente en sujetos con hiperlipidemia, diabetes y síndrome metabólico DOI: 10.1093/cvr/cvac128.
PLANTAS MEDICINALES
En un metaanálisis de 11 ECA de 816 participantes con diabetes o enfermedad hepática, se encontró que la suplementación con silimarina (cardo mariano ) disminuyó el CT (−0,45 mmol/L), el LDL-C (−0,27 mmol/L; IC ) y los TG (−0,29 mmol/L) y aumentó el HDL-C (0,09 mmol/L; ) (doi.org/10.1002/ptr.7364).
En un ensayo piloto doble ciego, controlado con placebo, de 8 semanas de duración, realizado a 67 pesonas. 300 mg de extracto de acuoso de hojas y tallos de Cissus quandrangularis, baja el colesterol – 195-> 177 mg/dl. TGL de 139 a 126 mg/dl. LDL-C de 127 a 104 mg/dl y HDL de 40 a 47 mg/dl (PMCID: PMC6352552 )
En un ECA con pacientes hiperlipidémicos (hipercolesterolémicos y/o hipertrigliceridémicos) de entre 20 y 60 años, un extracto hidroalcohólico estandarizado de gayuba (Arctostaphylos uva-ursi) ( (una cápsula de 350 mg cada 8 horas durante 2 meses. La gayuba redujo el colesterol total, los triglicéridos y el colesterol LDL en un 27,6 %, un 19,2 % y un 26,3 %, respectivamente, pero aumentó el colesterol HDL en un 37,5 % en comparación con el valor basal ( DOI: 10.1002/ptr.5011). En un ECA, 50 pacientes adultos hiperlipidémicos, extracto del fruto de V. arctostaphylos o placebo dos veces al día durante 4 semanas. (500 mg, cápsula contenía 45 ± 2 mg de antocianinas ). El extracto redujo significativamente el colesterol total ( 226 a 192 mg/dl), el colesterol LDL ( 132 a 121 mg/ dl), los triglicéridos ( 226 a 156 mg/dl ) y el MDA ( p = 0,013) en comparación con el placebo, pero no tuvo un efecto significativo sobre el colesterol HDL ( PMCID: PMC3920853).
Un metaanálisis de los ensayos mostró que el guggul (Commiphora mukul) redujo los niveles de colesterol total y de lipoproteínas de baja densidad (LDL) en 16,78 mg/dL y 18,78 mg/dL (IC del 95 , respectivamente (PMCID: PMC8229657).
El extracto de hoja de olivo (EHO) (136 mg oleuropein; 6 mg hydroxytyrosol) La administración de EHO, en pacientes hipertenson, indujo reducciones en el colesterol total plasmático [−0,32 (± mmol/L, ], el colesterol LDL [−0,19 mmol/L, ] y los triglicéridos [−0,18 , ] ( doi.org/10.1007/s00394-016-1188-y). Un metanalisis: 908 pacientes: TC – 9 mg/dl. LDL-C: < 4 mg/dl, TGL: < 9-14 mg/dl. (PMCID: PMC8575641).
En un metaanalisis e incluyeron 29 ECA con 2769 participantes; el consumo de llantén ( plantago mayor) redujo significativamente el colesterol total (CT) en 0,28 mmol/L y el colesterol LDL (LDL-C) en 0,35 mmol/L, (doi.org/10.1016/j.nutres.2024.03.013 ).
En 80 pacientes con angina crónica estable, 3 gr al dia de melisa < TC ( 166 a 144 mg/dl., TGL (198 a 157 mg/dl), LDL-C (90 a 75 mg/dl), HDL (de 34 a 41). PRC ( 4,2 a 2), > PN01 ( 110 a 124). (DOI: 10.6133/apjcn.022018.01). El metaanálisis incluyó 5 ensayos controlados aleatorizados con un total de 302 pacientes. Los resultados indicaron que el consumo de melisa produjo una disminución significativa en los niveles de TG (DME -0,396 ), CT (DME -0,416 ) y LDL (DME : -0,23) en comparación con el grupo placebo ( PMCID: PMC10996117 ).
El consumo de melón amargo (Momordica charantia) produjo una disminución significativa en las concentraciones plasmáticas de colesterol total (CT) (DMP; -9,71 mg/dL; y triglicéridos (TG) (DMP; -10,24 mg/dL; ), mientras que no redujo significativamente las concentraciones sanguíneas de colesterol LDL (DMP; -8,66 mg/dL;) ni de colesterol HDL (DMP; 0,54 mg/dL). El análisis de subgrupos mostró una disminución significativa del CT y del colesterol LDL, y un aumento del colesterol HDL, con una dosis ≤ 2000 mg/día y un periodo de intervención ≤ 8 semanas. ( DOI: 10.1002/ptr.8357).
En el estudio de pacientes con diabetes tipo 2 (DM2). En comparación con el grupo control, el grupo experimental que recibió 8 g de polvo de hojas de Moringa oleifera diariamente durante 40 días experimentó una disminución significativa en los niveles plasmáticos de colesterol total (CT) (−14 %), colesterol LDL (LDL-C) (−29 %), colesterol VLDL (VLDL-C) (−15 %) y triglicéridos (TG) (−14 %). El colesterol HDL (HDL-C) aumentó un 9 % ( PMCID: PMC3290775).
La cúrcuma y los curcuminoides podrían reducir los TG en sangre en -19,1 mg/dL , el CT en -11,4 mg/dL y el colesterol LDL en -9,83 mg/dL , y aumentar el colesterol HDL en 1,9 mg/dL . ( PMID: 31212316).
En un ECA, se estudio el efecto del romero en polvo sobre el perfil lipídico en humanos. Se evaluaron dosis 5 o 10 gr de romero al dia, durante 4 semanas; El romero en polvo baja el CT ( 5 gr de 200 a 178 y 10 gr d 232 a 152 mg /dl, el LDL-C ( 5 gr de 137 a 98 y 10 gr de 140 a 92 mg/dl, los TGL ( 5 gr de 169 a 133 y 10 gr de 172 a 122 mg/dl) y sube el HDL ( 5 gr de 46 a 53 y 10 gr de 48 a 59 mg/dl).( DOI:10.4236/ijcm.2014.56044).
Por lo tanto, en este ensayo clínico aleatorizado, doble ciego y controlado con placebo, con 67 pacientes hiperlipidémicos (hipercolesterolémicos y/o hipertrigliceridémicos) con una edad media de 56,4 ± 30,3 años (media ± DE), se evaluaron los efectos de la ingesta de extracto de hojas de salvia (una cápsula de 500 mg cada 8 horas durante 2 meses) sobre los niveles sanguíneos en ayunas de lípidos, creatinina y enzimas hepáticas, incluidas la SGOT y la SGPT, en 34 pacientes, y se compararon con el grupo placebo (n = 33). El extracto redujo los niveles sanguíneos de colesterol total (- 18%), triglicéridos (- 22,8 %), LDL (-19%) y VLDL (- 13.3 %), pero aumentó los niveles sanguíneos de HDL (+ 20 %) sin efectos significativos sobre los niveles sanguíneos de SGOT, SGPT y creatinina en comparación con el grupo placebo al final del estudio. No se notificaron efectos adversos. (DOI: 10.1002/ptr.3506 )
Un metaanálisis en red de 25 ECA con 1487 participantes, que comparó el extracto de té verde con placebo, reveló que quienes recibieron té verde presentaron una disminución significativa del colesterol total (CT) (−0,18 mmol/L; ) y del colesterol LDL (−0,17 mmol/L;) DOI: 10.1016/j.phrs.2022.106402.
Casa Terapéutica Torremolinos. 29620. Málaga.
Tlfno, 646210611 y 952563205
casaterapeuticatorremolinoscom.blog
aceite de pescado, ajo, alcachofa, aloe, Amla, Arctostaphylos uva-ursi, ácido alfa lipoico, berberina, Bifidobacterium lactis, casaterapeutica torremolinos, casaterapeuticatorremolinos, cúrcuma, chitosan, cissus, Cissus quandrangularis, coenzyma Q10, colesterol, comino negro, curcuminoides, dislipidemia, EPA, espino amarillo, espirulina, gayuba, glucomanano, goma guar, guggul, HDL-C, hipercolesterolemia, Hoja de olivo, konjak, L-carnitina, L.reuteri, Lactobacillus casei, LDL-C, linaza, melisa, melisa officinales, moringa olifera, nigella sativa, oligochek, pantetina, pectina, psilio, q10, quitosano, resveratro, resveratrol, romero, rosmarinus, salvado de avena, salvia, siliramina, té verde, trigliceridos -
Hipertrofia Benigna de Próstata y Oligochek
Causas y Tratamientos de la Hipertrofia Benigna de Próstata
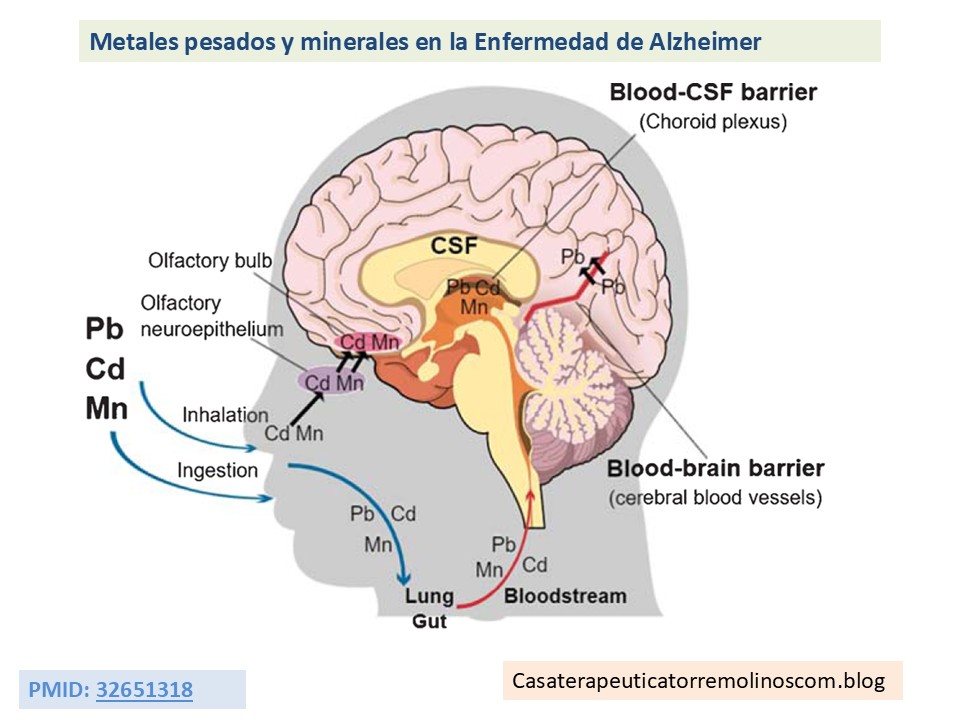
La hipertrofia prostática benigna (HPB) se refiere al crecimiento no maligno o hiperplasia del tejido prostático y es una causa frecuente de síntomas del tracto urinario inferior (STUI) en hombres mayores. El desarrollo de la hiperplasia prostática benigna (HPB) se caracteriza por la proliferación de células estromales y epiteliales en la zona de transición de la próstata, que rodea la uretra. Esto provoca compresión uretral y obstrucción del flujo de salida de la vejiga, lo que puede ocasionar síntomas del tracto urinario inferior (STUI), retención urinaria o infecciones por vaciamiento incompleto de la vejiga. En primer lugar, existe un componente estático, que consiste en la obstrucción directa del tracto de salida de la vejiga causada por el tejido agrandado. En segundo lugar, existe un componente dinámico debido al aumento del tono muscular liso del cuello vesical . Los síntomas obstructivos incluyen, por ejemplo, la intermitencia del flujo urinario y la sensación de vaciado incompleto de la vejiga debido a la retención urinaria o goteo terminal. El componente estático causa síntomas irritativos, como incontinencia, nicturia o hematuria.
Etiologia
La prevalencia de esta enfermedad multifactorial aumenta con la edad. Con el envejecimiento, disminuyen los niveles plasmáticos de testosterona y la relación testosterona/estrógeno, lo que conlleva un aumento de la actividad estrogénica, que puede facilitar la hiperplasia de las células prostáticas. Otra teoría se centra en la dihidrotestosterona (DHT) y la actividad de la enzima 5α-reductasa, que convierte la testosterona en DHT. En los hombres mayores, la actividad de esta enzima aumenta, lo que reduce la relación testosterona/DHT. La DHT puede promover el crecimiento de las células prostáticas, lo que resulta en hiperplasia. Pero los andrógenos no son los únicos factores que causan la HPB. Entre los factores independientes de los andrógenos se incluyen la isquemia, el estrés oxidativo, el síndrome metabólico, las infecciones, las reacciones autoinmunitarias, la inflamación y los métales pesados y el desequilibrio de los minerales.
Metales pesados
La evidencia publicada sugiere que los pacientes con HPB tienen un riesgo de dos a tres veces mayor de desarrollar Cáncer de próstata (CaP) y un riesgo de dos a ocho veces mayor de mortalidad asociada al CaP. lo que sugiere que la HPB es un factor de riesgo para el CaP. ( doi.org/10.1038/s41389-020-0202-7 ).
En un estudio sobre 116 pacientes con HBP, en la India, había una asociación del cadmio y el plomo con el estado antioxidante y la incidencia de hiperplasia prostática benigna (DOI: 10.1007/s12011-013-9630-y ).
En un estudio de casos y controles con pacientes con hiperplasia prostática benigna (HPB, n = 104), cáncer de próstata (CaP, n = 58) y controles (n = 107), se determinaron los metales pesados plomo (Pb) y cadmio (Cd). Se observaron niveles más elevados de plomo (Pb) y cadmio (Cd) en la hiperplasia prostática benigna (HPB) y el cáncer de próstata. En el CaP, el Pb y el Cd mostraron una correlación significativa con el volumen prostático. Además, en pacientes con HPB, el PSA, la puntuación IPSS y el volumen premiccional se correlacionaron positivamente con el Pb. ( DOI: 10.1016/j.urolonc.2023.04.022 ).
Se observaron concentraciones medias de Al, Cr, Pb, Cd, Na, Ni y K significativamente mayores ( p < 0,05) en el suero de pacientes con hiperplasia prostática benigna (HPB) en comparación con los controles sanos, mientras que los niveles promedio de Sb, Al, Cd, As, Mn, Sr, K y Pb fueron significativamente superiores ( p < 0,05) en pacientes con cáncer de próstata (CaP). (DOI: 10.1007/s12291-024-01209-9 ).
La exposición neonatal al cloruro de aluminio predispone a los jerbos adultos y seniles a la hiperplasia prostática ( DOI: 10.1002/cbin.11995 ).
Minerales
En un estudio sobre 456 hombres: Altos niveles de boro en orina se relaciona con PSA bajo y volumen prostático bajo (DOI: 10.1007/s12011-011-9023-z ).
La prevalencia de hipomagnesemia en pacientes con HBP fue del 86,7% en conjunto con una hipercalcemia del 36,7%. (PMCID: PMC5346265), El calcio produce proliferación y el Magnesio apoptosis.
Los estudios demuestran que los hombres con hiperplasia prostática benigna (HPB) presentan concentraciones más bajas de zinc en el tejido prostático y el plasma, y excretan más zinc en la orina en comparación con los hombres sanos (PMCID: PMC3114577 ).
El riesgo de hiperplasia prostática benigna (HPB) disminuyó significativamente al aumentar la concentración sérica de selenio; la estimación del riesgo fue de 0,83 (IC del 35%: 0,69-0,99) por cada aumento de 10 µg/L en la concentración sérica de selenio (DOI: 10.1111/j.1464-410X.2012.11383.x).
La remodelación estromal, en particular la diferenciación de fibroblastos a miofibroblastos, es una característica distintiva de la hiperplasia prostática benigna (HPB) y de los tumores sólidos, incluido el cáncer de próstata (CaP). El aumento de la producción local de TGFβ1 se considera el estímulo inductor; el selenio inhibe esta diferenciación por un mecanismo antioxidante (PMCID: PMC5417274 ).
Los niveles de cadmio (Cd), níquel (Ni) y cobre (Cu) fueron significativamente mayores, en suero, en los pacientes con HPB que en los controles, mientras que el mercurio (Hg) presentó los niveles más altos en los pacientes con CaP. (doi.org/10.1016/j.envint.2018.10.034 ).
Caso Clínico
Paciente de 78 años de edad diagnosticado de STUI y Elevación del PSA y en Tratamiento con Tamsulosina 0,4 mg. una al día. Se añade al tratamiento:
Zinc citrato 15 mg un comprimido día noche.
Selenio-metionina 100 mcg un comprimido dia con el desayuno.
Preparado de fibra dietética ( psillio+ pectina de manzana y salvado de avena) 3 gramos día.
Magnesio citrato. 100 mg/ día de magnesio elemental.
Extracto de raíz de ortiga, 500 mg día extracto estandarizado con 1% de beta-sitosterol un comprimido día
Serenoa repens extracto estandarizado de 160 mg cada 12 horas.
Pipas de calabaza 5-7 gr cada 12 horas.
Quelación de metales pesados.
Dado que este paciente presenta metales pesados que pueden ser la causa o un factor perjudican para la HBP, era necesario incluir en su tratamiento suplementos con efecto quelante estos metales; así tenemos:
El Zinc. En pacientes en diálisis con altas concentraciones de aluminio en sangre, la suplementación de Zn baja las concentraciones de Al y el estrés oxidativo y mejora el estado del Selenio. ( PMCID: PMC3705357 ). La absorción de cadmio es reducida por el zinc, calcio y selenio ( DOI: 10.1016/j.ecoenv.2023.114878 ).La deficiencia de zinc se ha revelado como el mecanismo citotóxico del cadmio (Cd). A concentraciones muy bajas, el Cd induce la expresión de un transportador de flujo, ZnT1, que funciona como un intercambiador Zn/Ca; en consecuencia, el zinc es expulsado de las células por ZnT1. ( PMCID: PMC11853145). La deficiencia de zinc, vitamina C, proteínas y fósforo aumenta la absorción de plomo ingerido( DOI: 10.1007/s10534-005-2993-6 ). Es un metal esencial que posee efectos mitigantes en la toxicidad del Pb dado que compite con éste por proteínas transportadoras presentes en el tracto gastrointestinal.
Magnesio. La administración de aspartato de magnesio protege al córtex cerebral de la acumulación de aluminio, dado que la administración del mismo disminuye la concentración de aluminio en el cerebro. (PMCID: PMC53567 ). La suplementación con Mg redujo el contenido de Cd de riñón después de 2 semanas durante aproximadamente 30%, en comparación con los animales tratados sólo con Cd (DOI: 10.1016/j.jtemb.2024.127469) . La ingesta excesiva de Mg oral tiene efectos beneficiosos en la intoxicación crónica por Pb, que induce la disminución de la carga corporal de Pb y su mayor eliminación a través de la orina (PMID: 9884986 ). En humanos, la suplementación con magnesio y selenio incrementó las pérdidas fecales aparentes de cobre. (DOI: 10.1007/978-1-4613-0537-8_4 ).
Selenio. El selenio es capaz de eliminar las cinco neurotoxinas , concretamente Al , As, Pb, Mn y Hg. El selenio atenúa la peroxidación lipídica y mejora los cambios bioquímicos producida por Al ( DOI: 10.1007/s12011-015-0229-3 ). El selenio 2 restauró la actividad de SOD y CAT, aumentó el contenido de vitamina C en el cerebro. También disminuyó el nivel de Cd en los pulmones. ( DOI: 10.1016/j.toxlet.2007.07.011). El selenio bajo en trabajadores expuestos a plomo. (PMCID: PMC3510413 ). ( PMCID: PMC8994004 ). Posee además un efecto protector contra los efectos tóxicos del Pb, el cual ha sido atribuido a su capacidad de unirse fuertemente a este metal para formar complejos Asimismo, ha sido observada una correlación negativa entre niveles de PbS y Se en plasma de niños expuestos a Pb ( DOI: 10.1016/s0009-9120(98)00071-x ), lo que podría estar sugiriendo un efecto quelante de esta sustancia.
La fibra dietética. Los resultados de varios estudios sugieren que la suplementación dietética de silicio podría ser de valor terapéutico para la prevención crónica de aluminio acumulación en el cerebro (DOI: 10.1111/j.1753-4887.2010.00360.x). El silicio se combina con el aluminio en el tubo digestivo y facilita su excreción por las heces (DOI: 10.1021/es7028608). En la enfermedad de Alzheimer el que consumir hasta 1 litro de agua mineral rica en silicio cada día durante 12 semanas facilitó la eliminación de aluminio a través de la orina tanto en el paciente como en los grupos control sin ningún efecto concomitante ( DOI: 10.3233/JAD-2012-121231 ). La exposición humana al aluminio se ha relacionado con la esclerosis múltiple, y se sabe que las personas afectadas excretan cantidades inusualmente altas de aluminio en la orina. En 15 pacientes diagnosticados de esclerosis múltiple secundaria progresiva el consumo de agua rica en silicio aumento la excreción urinaria de aluminio significativamente (PMCID: PMC5832610). Tanto la pectina de manzana como el psilio son muy ricos en silicio. Además, el contenido de plomo en los hígados de ratas tratadas con pectina fue significativamente menor que en animales no tratados www.lead.org.au/fs/fst57.html. En general, durante la terapia de quelación, la movilización debe ser igual a la excreción, por lo que la hidratación adecuada y la regularidad intestinal son esenciales. Una variedad de productos puede ayudar a interrumpir la recirculación enterohepática de sustancias tóxicas, como el plomo, incluida la colestiramina, el carbón, el psyllium, y otros. La pectina es una fibra soluble que aumenta la excreción de metales pesados ( DOI:10.1016/j.tifs.2019.07.033 ).
Casa Terapéutica. Torremolinos. 29620. Málaga. Tlfn. 646219611. 952563205. https://casaterapeuticatorremolinoscom.blog .
boron, cadmio, casaterapeuticatorremolinocom.blog, casaterapeuticatorremolinos, cáncer de próstata, cobre, enfermedad de alzheimer, esclerosis múltiple, hipertrofia benigna próstata, magnesio, oligochek, pectina de manzana, pipas de calabaza, plomo, raiz de ortiga, selenio, serenoa repens, silice, STUI, zinc -
Homeopatia

Casa Terapéutica. Torremolinos. 29620. Málaga. Tlfno. 646219611. 952563205. casaterapeuticatorremolinoscom.blog
-
Metales pesados y Tiroiditis de Hashimoto

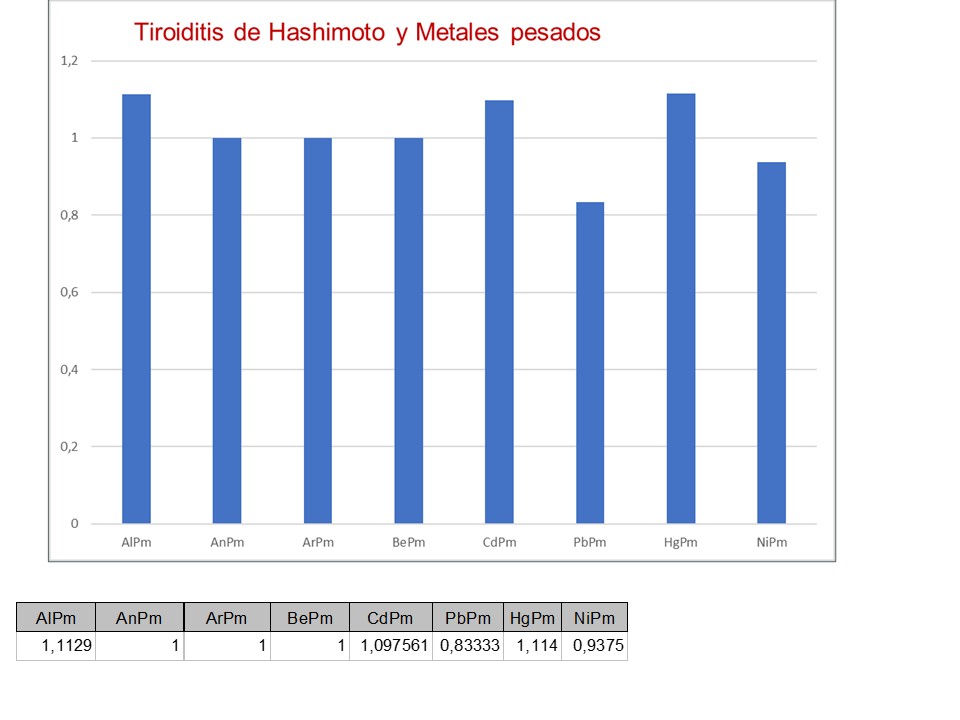
Caso clínico. Paciente que acude a consulta médica para hacerse estudio de metales pesados, porque padece una Tiroiditis de Hashimoto y en su última revisión le han aumentado la dósis de eutirox de 50 a 75 mg. En la analitica realizada se detecta que el nivel de aluminio, mercurio y cadmio esta alto.
1.- Aluminio. Aunque no se ha demostrado una relación directa entre el aluminio y la tiroiditis de Hashimoto, si es cierto que el toxicidad por el aluminio esta muy relacionada con la autoinmuniad. Además, en estudio en humanos se observó un mayor riesgo de nódulo tiroideo asociado con aluminio, cobalto y níquel. Por tanto, se sugiere que la exposición a múltiples metales conduce a un ataque multifacético a la tiroides desde el parénquima tiroideo hasta la función hormonal. DOI: 10.1016/j.jhazmat.2023.132115
2.- Mercurio. Las mujeres tienen un mayor riesgo de padecer trastornos autoinmunes; la exposición al mercurio se ha asociado con la autoinmunidad celular y el mercurio se acumula en la glándula tiroides. En comparación con las mujeres con los niveles más bajos de mercurio (≤0,40 μg/L), las mujeres con niveles de mercurio >1,81 μg/L (quintil superior) mostraron una probabilidad 2,24 veces mayor (IC del 95 % = 1,22, 4,12) de positividad para autoanticuerpos de tiroglobulina . DOI: 10.1016/j.envint.2011.11.014
3. Cadmio. Nuevos estudios en humanos examinaron el posible papel de Cd en procesos autoinmunes en la glándula tiroides. El estudio basado en el estudio 2014 SPECT-China (que incluye 5628 adultos chinos) mostró la relación de los niveles de Cd en sangre y los anticuerpos a las proteínas tiroideas y la disfunción tiroidea reflejada por los niveles totales de T3, T4 total y TSH . Los niveles de Cd en sangre se correlacionaron positivamente con un mayor nivel de TSH e hipotiroidismo en las mujeres y mayores niveles de anticuerpos en las mujeres. Estas observaciones sobre la autoinmunidad tiroidea inducida por el sexo se explicaron por la capacidad del Cd para activar los receptores de estrógenos probados tanto in vivo como in vitro, ya que el estrógeno tiene efectos reguladores sobre las células inmunes innatas. Además, en un estudio de casos y controles transversales que investigó el estado de algunos elementos esenciales y algunos metales tóxicos y metaloides (entre los que se encontraba el Cd) en la sangre de 22 mujeres, se encontró que los pacientes con tiroiditis de Hashimoto e hipotiroidismo manifiesto poseen niveles más altos de Cd en comparación con los niveles de Cd en 55 mujeres sanas. PMID: 29772829. Sin embargo, estos mismos autores refieren que los resultados observados son complejos y, a menudo, contradictorios, probablemente mediados por diferencias de sexo y por la duración y los niveles de exposición de Cd. Los resultados también podrían verse afectados por el hecho de que las poblaciones observadas son una mezcla de aquellos con una función tiroidea normal y aquellos con enfermedades tiroideas no diagnosticadas o subclínicas potenciales.
Tratamiento..
1.- Cambios en hábitos dietéticos, eliminar aluminio de su dieta: latas, utensilios de cocina de aluminio, papel albal, conservas en lata de aluminio sobre todo el atún.
2. – Evitar atún y pez espada
3- Cadmio: Consumir cereales de buena calidad ( sobre todo el arroz), las verduras de hoja como espinacas, acelgas y lechuga, pueden acumular cadmio, dado que se encuentra en algunos fertilizantes. Evitar el lino. No abusar de setas y champiñones ni del cacao. Los crustáceos sobre todo la parte carne oscura evitarla.
4. Tratamiento natural
– Calcio 150 mg+ Magnesio 50 mg+ selenio 100 mcg+zinc 6 mg y cobre 0.5 mg una vez al dia
– Acido alfa lipoico. 50 mg cada 6 horas.
– Myo-inositol. 500 mg cada 12 horas.
– Vitamina D3. 500 UI. día.Casaterapeutica. Torremolinos. 29620. Málaga. Tlfno. 646219611
-
Osteopenia y Minerales


Caso Clínico. Paciente diagnosticada de osteopenia en tratamiento calcio 400 mg al dia y vitamina D3. 400 U.I. En analisis de un mes antes de la visita, el nivel de vitamina D en sangre eran normales 38 ng/ml (20-50 ), el de calcio mas bien alto 10,5 mmol/ l. ( 8,7-10,4).
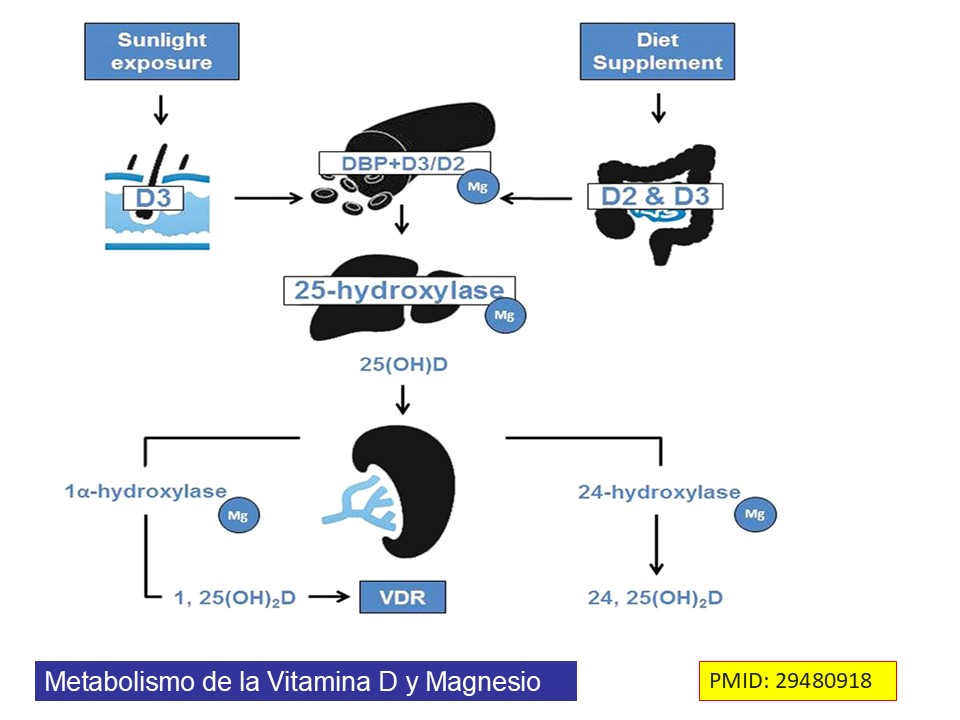
La vitamina D3 (colecalciferol) se produce en la piel cuando se expone a la luz solar. Por lo tanto, la vitamina D no es una vitamina real. Las personas con una exposición óptima a la luz solar no necesitan consumir suplementos dietéticos. Debido a que las dietas estándar generalmente no contienen suficiente vitamina D, la exposición segura a la luz solar o el consumo de alimentos suplementados artificialmente con vitamina D son necesarios para evitar complicaciones relacionadas con la deficiencia de vitamina D. La vitamina D, ya sea D3 (fuente animal) o D2 (fuente no animal), no tiene una actividad biológica significativa. Más bien, necesita ser procesada más en el hígado y los riñones para generar la forma biológicamente activa 1,25-dihidroxivitamina D (1,25[OH] 2 D). Este proceso de activación ocurre en 2 pasos: (1) dentro del hígado, el colecalciferol es hidroxilado a 25-hidroxicolecalciferol (25 [OH] 2 D) por la enzima 25-hidroxilasa; y (2) dentro de los riñones, el 25-hidroxicolecalciferol se convierte en 1,25(OH) 2D por la enzima 1a-hidroxilasa. La actividad enzimática tanto de la 25-hidroxilasa hepática como de la 1a-hidroxilasa renal es un proceso dependiente del magnesio. La vitamina D se transporta en la sangre unida a las proteínas transportadoras, siendo la principal transportadora la proteína transportadora de vitamina D. Cabe destacar que la actividad de la proteína transportadora de vitamina D también es un proceso dependiente del magnesio. DOI: 10.7556/jaoa.2018.037.
El magnesio es el segundo catión intracelular más abundante y desempeña un papel fundamental en la mineralización ósea al influir en la síntesis de los metabolitos activos de la vitamina D y la hipovitaminosis D puede modificarse mediante el consumo de magnesio. La eficacia y los beneficios clínicos de la vitamina D se reducen significativamente cuando no se mantiene la homeostasis del magnesio en el organismo. La vitamina D también desempeña un papel clave en la absorción intestinal de fosfato y magnesio, lo que influye en el proceso de mineralización ósea. Ademas un alto consumo de magnesio reduce el riesgo de deficiencia o insuficiencia de vitamina D en la población general PMCID: PMC3765911. Además, un estudio demostró que las personas que consumían la mayor cantidad de magnesio (420 mg para hombres y 320 mg para mujeres) presentaban mayor densidad ósea y menor riesgo de osteoporosis DOI: 10.1007/s12011-009-8416-8 . En comparación con los valores basales, los niveles séricos de osteocalcina disminuyeron un 5 % en las mujeres que no recibieron suplementos de magnesio (grupo control), mientras que aumentaron aproximadamente un 44 % en las que sí los recibieron DOI:10.1007/s12011-009-8416-8 . Los niveles séricos de PTH disminuyeron un 32 % en el grupo suplementado con magnesio, en comparación con un 4 % en el grupo control DOI: 10.1007/s12011-009-8416-8. El consumo de la dosis diaria recomendada (DDR) de magnesio podría ser más eficaz que la vitamina D para prevenir la pérdida ósea, ya que el magnesio potencia la actividad de la vitamina D, posiblemente al aumentar su absorción y activación endógena 10.3945/ajcn.113.067488. En el hueso, el magnesio se une a la superficie de los cristales de hidroxiapatita para determinar su tamaño. Los cristales en huesos con deficiencia de magnesio son más grandes y pueden formar huesos frágiles propensos a fracturas doi.org/10.1111/j.1753-4887.1995.tb01505.x .Además de la mineralización ósea, el magnesio también contribuye a la proliferación de osteoblastos, y su deficiencia afecta la formación ósea. DOI: 10.1684/mrh.2017.0422.
Diversos estudios sugieren que el magnesio podría influir en la síntesis de PTH y determinar el número de receptores de vitamina D; por lo tanto, una deficiencia de magnesio podría conllevar una disminución en la síntesis y secreción de PTH y una reducción en el número de receptores de vitamina D disponibles en las células diana. 10.1093/ndt/gft400 ). Por todo lo anterior, el magnesio bien a través de su interacción con la vitamina D; su papel regulador sobre la PTH y su acción directa; es imprescindible para la mineralización ósea.
Casaterapeutica. Torremolinos. 29620. Málaga
646219611. casaterapeuticatorremolinoscom.blog -
Trastorno Bipolar y Minerales
Trastorno bipolar.
El trastorno bipolar (TB) es un trastorno mental grave caracterizado por alteraciones episódicas en el estado de ánimo y los niveles de actividad que incluyen depresión, hipomanía y manía. Es una de las principales causas de discapacidad y afecta a ~1% de la población mundial (PMCID: PMC3486639; DOI: 10.1038/nrdp.2018.8). Como una enfermedad crónica, el BD puede provocar deficiencias funcionales a largo plazo y una calidad de vida reducida tanto para los pacientes.
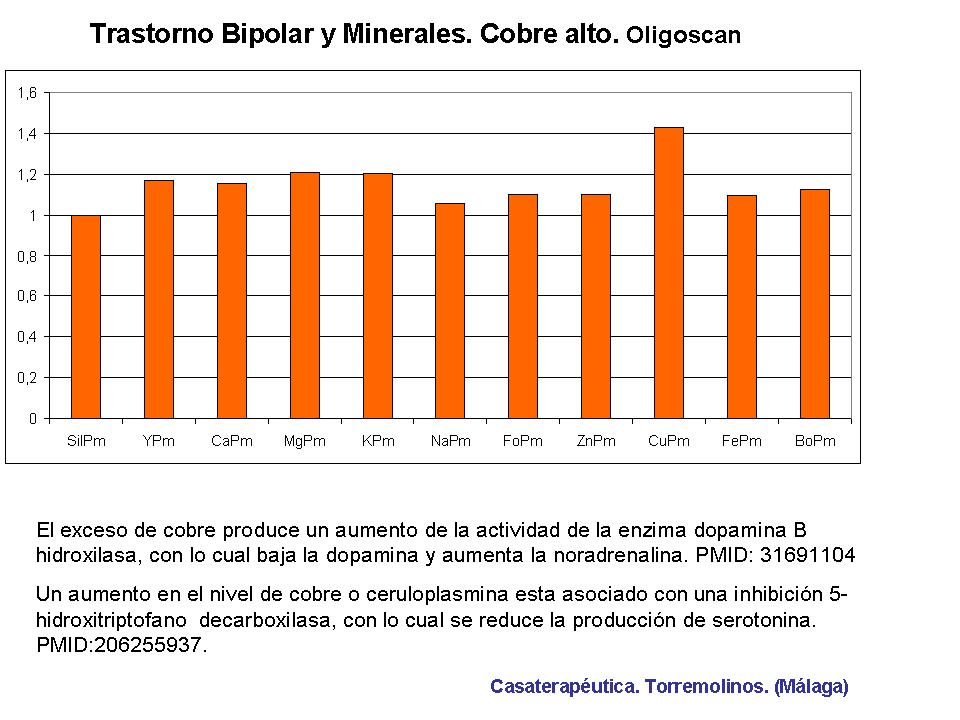
En un paciente diagnosticado de trastorno bipolar y en tratamiento médico, se realiza un Oligochek para determinar los minerales y metales pesados en la piel de la mano. El nivel de metales pesados era normal, pero el nivel de cobre MUY ALTO era lo más significativo. El exceso de cobre se ha relacionado con muchas enfermedades mentales: el cobre activa la dopamina B hidroxilasa ( PMID: 31691104) e inhibe la 5-hidroxitriptofano decarboxilasa (DOI: 10.1007/s12011-010-8766-2) , por tanto altera el nivel de Dopamina y Serotonina. Los desequilibrios de estos neurotransmisores se han asociado con la esquizofrenia paranoide, el trastorno bipolar, la depresión posparto, el TDAH, el autismo y las conductas violentas. La mayoría de las personas con niveles elevados de cobre presentan niveles bajos de zinc y estrés oxidativo excesivo. Este paciente presenta niveles bajos de selenio. ( ver gráfica 2)
En este caso; las terapias con nutrientes para normalizar los niveles de cobre son efectivas para equilibrar los niveles de dopamina y norepinefrina y por tanto un tratamiento más para el trastorno bipolar.

Casaterapeutica Torremolinos. 29620. Málaga casaterapeuticatorremolinoscom.blog . Tfno. 6462196611 y 952563205 casaterapeuticatorremolinoscom.blog
https://www.facebook.com/profile.php?id=100054494289399
-
El Cobre


El Cobre su importancia en la salud.El cobre es un nutriente esencial en humanos y actúa como un factor crítico cuando se incorpora dentro de especificas cuproenzimas que catalizan las reacciones de transferencia de electrones necesarias para la respiración celular, la oxidación del hierro, la formación de pigmentos, la biosíntesis de neurotransmisores, sistemas antioxidantes, la regulación de péptidos y la formación del tejido conjuntivo.
– Nombres: COPPRE, COPPER, COBRE, CUVRE, KUPFER, MEDN,
– Numero atómico. 29
– Peso atómico: 63.54.
– Produce una corriente eléctrica de 42 microamperios.
– Vibra en color índigo.
– Longitud de onda: 324,7
– Cuproso (Cu1+) y Cúprico. (Cu 2+)
En el cuerpo, cambios de formas de cobre entre el cuproso (CU1 +) y el cúprico (Cu2 +), aunque la mayoría de cobre del cuerpo está en forma de Cu2+
– La capacidad del cobre aceptar y donar fácilmente electrones explica su importante papel en la oxidación-reducción (redox), las reacciones y la compactación de los radicales libres.
1. FUENTES DE COBRE EN LA DIETA
– En mg/ 100 gr de alimentos.
– Ternera, hígado. 15,05.
– Cordero, hígado. 13,40.
– Ganso, hígado, crudo. 7,52.
– Algas marinas, espirulina, secas. 6,10.
– Pato, hígado, crudo. 5,96.
– Moluscos, ostras. 5,71
– Setas, shiitake, secas. 5,17
– Cacao, polvo seco, sin azúcar. 3,79
– Harina de soja. 2,92
– Fréjoles alados, semillas maduras. 2,88
– Semillas, semillas de sésamo. 2,47.
– Nueces, anacardos, crudo. 2,19.
– Moluscos, calamar, especies mixtas, cocinado, frito. 2,11.
– Especias, albahaca, seca. 2,10.
– Moluscos, calamar. 1,89.
– Semillas, semillas de girasol, secas 1,80.
– Especias, hoja de cilantro, seca. 1,79.
– Semillas, semillas de cártamo, secas. 1,75.
– Nueces, nueces de Brasil. 1,74.
– Avellanas. 1,73.
– Rábanos, orientales, secos. 1,63
– Especias, semillas de amapola. 1,63
– Nueces. 1,59.
– Crustáceos, langosta. 1,55.
– Menta verde, seca. 1,54
– Tomates, secados al sol. 1,42.
– Alimentos ricos en cobre por grupo de alimentos.
– Hígado (especialmente ternera, cordero, ternera)
– Mariscos (ostras, calamar, langosta, cangrejo)
– Frutas y verduras (verduras de hoja oscura, patatas, champiñones, aguacates, fruta seca)
– Semillas (sésamo, girasol, calabaza)
– Frutos secos (anacardo, avellanas, nueces de Brasil, nueces),
– Fréjoles (garbanzos, soja ).
– Queso de cabra
– Productos de soja (leche de soja, polvo de soja)
– Chocolate, cacao
– Cereales de salvado de trigo y productos integrales.
2. ABSORCION.
Excepto una pequeña cantidad en estómago, el cobre se absorbe principalmente en intestino delgado. La absorción tiene lugar por mecanismos de transporte pasivo y activo (saturable) y se regula según necesidades por la metalotioneína de las células intestinales.
– Hay además dos proteínas que regulan la absorción de cobre en el intestino, la DMT1 (dimetil metal transportadora-1) y la Ctr1.
– La disponibilidad puede a su vez verse reducida por ciertos estados capaces de favorecer la interacción entre sulfuros endógenos y exógenos y el cobre intestinal.
– 1. La fracción absorbida depende de la cantidad en el dieta, si aumentamos la cantidad en la dietas disminuye su absorción ( 0,78 mg/día-> 56%, 1,68 mg/día. > 36 % y 7,53 mg/día –> 12% de absorción.
– 2. Disminuyen su absorción
– La fructosa, carbohidratos, y celulosa disminuyen su absorción.
– La vitamina C, en grandes dosis, disminuye la absorción de cobre, (Kies y Harms 1989) el magnesio y el selenio. (Kies y Harms 1989).
– La suplementación de zinc aumenta las metalotioneínas, proteínas que se unen al cobre y previenen su absorción.
– El cobre aumenta la absorción intestinal y la utilización de hierro, mientras que el hierro puede inhibir la absorción de cobre .
– La fibra dietética puede disminuir la absorción de cobre.
– El consumo excesivo de molibdeno en la dieta puede formar complejos con el cobre y puede inducir una deficiencia de cobre.
-3. Aumentan su absorción.
– El calcio y el potasio ( Kies y Harms. 1989 )
– Las proteínas animales la aumentan
– Citratos, fosfatos y glutamatos forman complejos con el cobre y aumentan su absorción.
– L-histidina y L- cisteína pueden reducir la absorción de cobre, mientras que la glicina, L-triptófano y L-metionina la aumentan. (Gao S. y cols 2014 ).
– El ácido fítico , que se encuentra en nueces, semillas y fréjoles, mejora la absorción de cobre por su capacidad de unirse a otros componentes de la dieta que disminuyen la absorción de cobre en el intestino ( Lee y cols, 1988).
– 4. – Tiene un mecanismo competitivo de absorción con: Zinc, hierro,molibdeno, plomo y cadmio ( en Stern y cols. 2007).
3. TRANSPORTE
– El cobre liberado por los enterocitos se une a la albúmina, glutatión, y aminoácidos (histidina) y es transportado por la circulación portal al hígado. Además hay una proteína la transcupreina que transporta el Cobre.
– En el hígado, el cobre se une a la CERULOPLASMINA (alfa globulina) y es transportado por la sangre: tiene actividad ferroxidásica e interviene en la utilización del Fe.
– Ceruloplasmina: transporta la mayor cantidad (90 %) pero lo fija fuertemente y no lo cede fácilmente a nivel tisular. Esta proteína está alterada en la enfermedad de Wilson y en las enfermedades hepáticas en general.
– Albúmina: transporta solo el 10 % del Cobre, lo fija y lo libera fácilmente a nivel tisular.
4. ALMACENAMIENTO
– Entre un 50 y un 75% del total es almacenado en músculos y huesos. Las concentraciones altas hay en corazón, el riñón, el hígado y el sistema nervioso central.
– Sus concentraciones tisulares se regulan parcialmente por las metalotioneínas, pueden fijar Cobre, Zinc , Cadmio y Mercurio.
– Dentro del citosol, esta unido a metalotioneinas y también a los metalochaperones, que une el cobre más lábilmente. Se han descrito hasta seis de estos específicos para el cobre.
– El humano adulto contiene cerca de 50 a 120 mg de cobre y el 60% se encuentra en músculo, piel y esqueleto aunque los órganos con mayor concentración son hígado y cerebro.
– La cantidad media es de: 72 mg.
– El valor del cobre en el cabello debe estar entre 8 y 48 ppm.
– Se encontró que el cobre de cabello en ratas adultas de 500 días de edad se correlaciona directamente con el cobre en el hígado entero (Jacob y cols, 1978).
– La concentración en sangre es de 15 micromol/l.
– El Cu es captado por las células a través de una familia de proteínas transportadoras altamente conservadas denominadas Ctr (copper transporters) (Zhou y Gitschier, 1997).
– El Cu extracelular, que en su mayoría es Cu++, es reducido a Cu+ por enzimas reductasas que se encuentran en la membrana plasmática para luego ser captados por las Ctr hacia el citoplasma (Hassett y Kosman, 1995). En el humano existen dos Ctr principales (hCtr1 y hCtr2).
– Luego de atravesar la membrana plasmática, los
iones Cu+ son trasportados al compartimento secretor, a la mitocondria, y a las cuproenzimas citosólicas por medio de las chaperonas Cox 17, Atox1 (anti-oxidant 1) y CCS, respectivamente. Cox 17 transporta los iones Cu hacia las proteínas mitocondriales SCO1 y SCO2, las cuales los incorporan en el citocromo-c-oxidasa de la cadena respiratoria (Bertinato y L’Abbé, 2004). Luego Atox1 transfiere estos iones metálicos hacia las ATPasas encargadas de exportarlo (ATP7A y ATP7B.)
– Las proteínas ATP7 son una super-familia de ATPasas transportadoras de iones Cu que normalmente se localizan en el compartimento trans del aparato de golgi (TGN).
Estas ATPasas son responsables del transporte de los iones Cu desde el citosol a través de la membrana plasmática hacia otros compartimentos celulares o hacia el exterior de la célula utilizando la energía de hidrólisis del ATP.
5. ELIMINACION.
– Por la bilis que elimina el intestino; algo también en la orina, el sudor y el flujo menstrual.
– Cuando las concentraciones de Cu extracelular son elevadas, las ATPasas se trasloca hacia la membrana plasmática para eliminar el exceso de iones ( Metha y cols 2006).
– La bilis representa la principal vía de excreción de iones Cu, ya que el 80 % se elimina por esta ruta (Gaetke y Chow, 2003).
Causas de la deficiencia de cobre
1) Absorción de cobre inadecuada
– Enfermedad de Menkes.
– Cirugía de reducción de peso (bypass gástrico).
– Gastrectomía (extirpación del estómago) y esofagectomía (extirpación del esófago).
– Ingesta crónica de antiácidos.
– Aumento del consumo de zinc.
– Síndromes de malabsorción ( enfermedad de Crohn, enfermedad celíaca, síndrome del intestino corto ).
.2) Ingesta de cobre inadecuada
– Fórmula infantil baja en cobre o fórmula de leche de vaca.
– Nutrición parenteral durante largos períodos de tiempo sin suplementación de cobre.
– Desnutrición proteico-calórica.
3) Mayores requisitos
– Recién nacidos, especialmente prematuros.
– Embarazo y lactancia.
4) Pérdidas excesivas de cobre
– Estados malabsortivos.
– Agentes quelantes de cobre tales como penicilamina.
– Quemados.
– Síndrome nefrótico.
– Señales de deficiencia de cobre
– Anemia
– Neutropenia (niveles bajos de neutrófilos)
– Degeneración del tejido conectivo
– Retraso del crecimiento
– Anormalidades óseas
– Palidez
– Pobre control de temperatura
– Adelgazamiento, cabello débil
– Mala calidad de la piel
– Problemas neurológicos (en casos severos)
– Convulsiones (en casos severos).
FISIOLOGIA
Enzimas y proteínas que contienen cobre.

Acciones de las enzimas y proteínas que contienen cobre.
– 1. Producción de energía.
– Citocromo C oxidasa. Enzima necesario para el metabolismo energético, la respiración celular y la formación de mielina.
-2.- Formación de Mielina. Cofactor de dos enzimas importantes :
– Citocromo C oxidasa y galactosil-ceramida transferasa.
– La deficiencia de cobre puede producir mielopatía, predominante sensorial y atáxica (Videt-Gibou, y cols. 2010 ).
– 3. Función antioxidante.
– Las superóxido-dismutasa isoenzimas 1y 3 (SOD1 y SOD3).
– La Ceruloplasmina
– La glutatión peroxidasa convierte los compuestos de hidroperóxido en compuestos de hidróxido. Se ha informado que la actividad de esta enzima disminuye en caso de deficiencia de cobre en el hígado y el plasma. La deficiencia de Cu puede reducir la actividad de GPx al disminuir el ARNm de la enzima (Uriu-Adams y Keen 2005 ).
4. Detoxificante y antidegenerativa.
– Las metalotioneínas (MT) son proteínas de unión a metales ricos en cisteína de bajo peso molecular. Vienen al menos en dos isoformas codificadas por varios genes. Los papeles biológicos de las metalotioneínas son: desintoxicación de iones de metales, incluidos iones de metales esenciales no esenciales y en exceso, almacenamiento de microelementos esenciales, secuestro de especies reactivas a oxigeno (ROS) y especies de nitrógeno (Ogra et al., 2006) .).
Los MT se unen a los iones de Zn, Cu y Cd, principalmente, sin embargo, el cobre se une más fuertemente y puede desplazar a otros iones. En condiciones reductoras, las metalotioneínas pueden unir iones de cobre y hacerlos redox inactivos. Las metalotioneínas se inducen en condiciones deficientes de Cu para mantener las actividades de las enzimas Cu intracelulares, como la citocromo C oxidasa y para eliminar ROS en lugar de antioxidantes que contienen cobre, como Cu/ Zn-SOD (Ogra et al., 2006 ).
5. Síntesis y degradación de neurotransmisores.
– Dopamina- B- monooxigensa/hidroxilasa. Enzima dependiente de vitamina C, que cataliza la conversión de dopamina hacia norepinefrina (noradrenalina). El cobre la estimula.
– Inhibe la triptófano descarboxilasa, por lo tanto baja la serotonina.
– Componente de la monoamino oxidasa ( MAO).
-Componentes alfa-amidación (necesaria para el procesamiento de neuropéptidos y hormonas peptídicas).
– Fenilalanina hidroxilasa. Quelantes de hierro y de cobre inhiben la fenilalanina hidroxilasa humana. (Woo y cols, 1974).
– La fenilalanina-4-monooxigenasa con hierro y cobre como cofactores produce la hidroxilación de la fenilalanina. Esta enzima hace que la tirosina, un aminoácido no esencial, pueda sintetizarse en el cuerpo. Esto es importante porque la tirosina es necesaria para la síntesis de catecolaminas, norepinefrina, epinefrina, dopamina y adrenalina. La dopamina baja está involucrada en la depresión, la hipertensión y la esquizofrenia. [Hufton, 1995].
6. Formación de melanina.
– Tirosinasa. enzimas que catalizan la degradación de la tirosina hacia el precursor melanínico, dopaquinona (dihidrofenilalanina), a través de la generación del intermediario DOPA.
7. Antialérgico y antinflamatorio.
– Amino-oxidasas cobre-dependiente (AOCs): catalizan la conversión oxidativa de aminas hacia aldehído y amonio, en la presencia cobre y cofactores de tipo quinona.
– Se cree que es un modulador crítico de transmisión de señales, posiblemente por degradar aminas biógenas como la dopamina, la histamina y la putrescina.
– Se conocen en la especie humana dos isoenzimas mas: AOC2 de alta expresión retiniana, y AOC3, también denominada como VAP1 (vascular adhesiva proteína ), de alta expresión placentaria, que se expresa en la membrana celular endotelial reclutando linfocitos. ( Imamura y cols, 1998 ).
– Diamino oxidasa, es una enzima que contiene cobre y baja la concentración de histamina, (histaminasa ); por eso es importante en la alergia y la inflamación.
– En cultivos celulares de mastocitos, el cobre inhibe la liberación de histamina ( Sharma y Jande 1989).
– El tratamiento con cobre 2 mg/día durante 4 semanas, en el hombre aumento la actividad de la diamino oxidasa ( Jones y cols, 1997).
– En humanos, la histamina se puede metabolizar de dos maneras (Schwelberger, 2004 ).
La primera ocurre a través de la metilación del grupo imidazol para formar la N- metilhistamina inactiva por la proteína citosólica N-metiltransferasa. El segundo implica la desaminación oxidativa de la amina primaria a imidazol acetaldehído por la diamina oxidasa secretada (hDAO). Se cree que hDAO es la enzima de primera línea que interviene en la eliminación de histamina tanto endógena como exógena y se especula que se libera de las vesículas basolaterales para eliminar la histamina en respuesta a un estímulo externo (Schwelberger. 2004 , 2007 ).
– Una disminución heredada o adquirida en la actividad de hDAO se correlaciona directamente con la intolerancia a la histamina (Maintz & Novak. 2007 ).
– En macrófagos, pequeñas concentraciones de sulfato de cobre inhiben la fosfolipasa A2, mientras que altas concentraciones la estimulan ( Milanino y cols 1988).
– Cu 2+ fue el único ion metálico que disminuyó la producción de PGE 2 . Estos efectos pueden explicar los beneficios antiinflamatorios del Cu 2+ (Nagano y Bush, 2008).
– La ciclooxigenasa-2 está aumentada en ratas deficientes en cobre y la PGE2, (Schuschke y cols, 2009).
8. Anti artrósico.
– La glicoproteína de la matriz del cartílago, es otra cuproproteina, se localiza en los condrocitos y en las células epiteliales del ojo. Juega un rol en la formación de la matriz extra-celular, ( Tapiero y cols. 2003).
9. Metabolismo del hierro.
– Ceruloplasmina. Pasa el hierro ferroso (2+) a férrico ( 3+).
– Además, la cuproenzima, hefaestina, es una gran ferroxidasa anclada a la membrana que esta implicada en el metabolismo del hierro en mamíferos. La ferroportina transporta el hierro ferroso y lo exporta a través de la membrana basolateral del enterocito, pero la hefaestina aumenta la eficiencia de este proceso al oxidar el hierro transportado a su forma férrica y promover su liberación de la ferroportina.
– Su déficit produce anemia.
– 10. Formación del tejido conjuntivo.
– Lisil oxidasa, Una cuproenzima ; juega un rol importante en la formación, maduración y estabilización del tejido conjuntivo.
– Su déficit Síndrome de Marfan.
– Lisil oxidasa cataliza la oxidación de ciertos residuos de lisina e hidroxilisina. Los aldehídos peptídicos así formado se convierten en centros activos para la formación de enlaces cruzados en el colágeno y la elastina ( Harris y cols, 1980).
– El cobre oxida el ácido ascórbico a acido deshidroascórbico (forma activa de la vitamina C).
– El acido deshidroascorbico produce la hidroxilación de la prolina y por tanto la formación del colágeno.
– Por tanto el cobre es necesario para la formación de ligamentos, tendones musculares, tejido conjuntivo y de las paredes vasculares.
– La homocisteina esta elevada cuando el cobre esta bajo en sangre.
– Las ratas deficientes en cobre tienen una disminución de aproximadamente 28% en la actividad paraoxonasa ( Klevay 2004 ).
– La deficiencia de cobre disminuye la actividad de la metionina sintasa que contribuye a la elevación de la homocisteína, y de la paraoxonasa que facilita la hidrólisis de la homocisteína tiolactona, un inhibidor de la lisil oxidasa ( Klevary LM, 2006).
– 11. El cobre actua sobre la coagulación de la sangre.
– Factores V y VIII de la coagulación.
– Otras acciones del cobre con actividad de cofactor.
12. Interviene en la actividad de la catalasa.
Convierte peróxido de hidrogeno a agua y oxigeno. La deficiencia de cobre produce una reducción de la actividad de este enzima en hígado y corazón (Uriu_adams y Keen, 2005).
– 13. Metabolismo del colesterol..
– El cobre actúa sobre El colesterol lécitin-acetil-transferasa, une el colesterol libre al HDL.
– El cobre actúa sobre la enzima colesterol-a-hidroxilasa que convierte el colesterol en ácidos biliares y por tanto favorece su eliminación.
– El cobre baja el colesterol total y el colesterol-LDL y eleva el HDL.
– Por tanto el déficit de cobre puede producir hipercolesterolemia.
RESUMEN DE ACCIONES DEL COBRE
– El cobre en estado libre es un poderoso oxidante, por ello la suplementación con cobre debe ser con cuidado y muchas veces si no se sabe su nivel, es aconsejable utilizar el cobre en pequeñas dosis homeopáticas reguladoras.
No obstante debemos pensar en un déficit de cobre en caso de:
-. Anemia ferropénicas refractarias.
-. Artrosis.
-. Mielopatía.
-. Hipercolesterolemia.
-. Fatiga crónica.
-. Enfermedades del tejido conjuntivo.
.- Inflamación crónica
.- Intolerancia a la histamina.
.- Depresión.
.-Trastornos de la pigmentación: vitíligo, canas.
.- Trastornos de la metilación.
.- Alergias.
.- Enfermedades del tejido conjuntivo.
.- Déficit de colágeno.
.- Envejecimiento.
.- Oxidación.
.- Dislipemia.
— Etc.
Casa Terapéutica. C/Ecija. nº. 16 Torremolinos. 29620. Málaga. Tlfno. 646 21 9611. 952563205 casaterapeuticatorremolinoscom.blog https://www.facebook.com/profile.php?id=100054494289399
alergias, anemias ferropénicas, aneurismas, antioxidante, bupas gástrico, calcio, casaterapeutica torremolinos, casaterapeuticatorremolinos, casaterapeuticatorremolinoscom.blog, catalasa, cáncer, ceruloplasmina, colageno, diamino oxidasa, dopamina beta hidroxilasa., dopamina., enfermedad celíaca, enfermedad de crohn, fatiga crónica, hígado graso, hipercolesterolemia, histamina., histaminasa, intolerancia a la histamina, lisil oxidadas, melanoma, mielina, oligochek, oligoscan, oligosenso, paraoxonasa, potasio, síndrome nefrótico, serotonina, serotonina., tiroides, tirosinasa, triptófano descarboxilasa, varices, vitiligo, zinc -
Hipertensión minerales y oligoelementos
Suscríbete para seguir leyendo
Suscríbete para obtener acceso al contenido íntegro de esta entrada y demás contenido exclusivo para suscriptores.
AGTR1, angiotensinogeno, antioxidante, azufre, calcio, casaterapeutica torremolinos, casaterapeuticatorremolinos, casaterapeuticatorremolinoscom.blog, cobalto, cobre, Comparative Toxicogenomics Database, disgenet, diurético, diureticos, fosforo, hierro, hipertensión arterial, HSD11B2, iodo, magnesio, manganeso, MMP2, molibdeno, NOS3, oligocheck, Paratohormona, potasio, PTH, renina, selenio, silice, sodio, Sulfato, vanadio, zinc
-
Suscribirse
Suscrito
¿Ya tienes una cuenta de WordPress.com? Inicia sesión.